Материаловедение
Электрохимическая коррозия
Электролиты - это химические соединения, которые в растворе полностью или частично диссоциируют на катионы и анионы( NaCl = Na+ + Сl-). Наличие положительно и отрицательно заряженных ионов придает растворам электролитов электропроводность. Диссоциация может происходить только в растворителях, молекулы которых полярны, например в воде. Молекулы воды являются диполями и электростатически взаимодействуют с ионами растворенною вещества, образуя гидратированные катионы и анионы. При гидратации иона выделяется энергия гидратации. При погружении металла в раствор электролита его поверхность заряжается. Если энергия гидратации ионов металла больше энергии химической связи атомов в решетке металла, то ионы металла переходят в раствор, а на поверхности металла остается эквивалентное количество электронов. Поверхность металла заряжается отрицательно и к ней притягиваются положительно заряженные ионы из раствора (рисунок 1 а). Если энергии химической связи атомов в решетке металла больше энергии гидратации ионов, то катионы раствора могут забирать электроны с поверхности металла. Поверхность металла заряжается положительно и к ней притягиваются отрицательно заряженные ионы из раствора (рисунок 1 б). В результате на границе раздела металл-электролит образуется двойной электрический слой (ДЭС), который характеризуется электродным потенциалом.
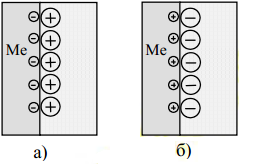
Рисунок 1 - схема строения двойного электрического слоя
Электродный потенциал - разность потенциалов в ДЭС между металлом и раствором. С течением времени процессы перехода ионов металла в раствор и адсорбции ионов раствора на поверхности уравновешиваются и значение электродного потенциала металла становится постоянным. Абсолютное значение электродных потенциалов определить невозможно, поэтому их измеряют относительно электродов сравнения. Основным электродом сравнения, потенциал которого условно принят за ноль, является стандартный водородный электрод, потенциал которого характеризует процесс 1/2Н2 — е- = Н+. Чем отрицательнее потенциал металла, тем выше его восстановительные свойства и склонность к коррозии - см. таблица 1. Металлы, имеющие потенциал меньше чем водород, будут окисляться водородом и кислородом. Металлы, у которых потенциал больше, чем у водорода, но меньше чем у кислорода, будут окисляться только кислородом. Те металлы, у которых потенциал больше, чем у кислорода, корродировать не будут (Au, Pt).
Таблица 1 - Электродные потенциалы

Механизм электрохимической коррозии. Электрохимическая коррозия возникает в результате работы множества короткозамкнутых гальванических элементов, образующихся вследствие химической и энергетической неоднородности металла (сплава). На рисунке 2 представлена схема коррозии стали со структурой феррит-цементит в растворе кислоты. На аноде - участке поверхности с более отрицательным потенциалом (феррит) происходит окисление железа и переход ионов в раствор, где они гидратируются:
Fe - 2е- = Fe2+
Анод при этом заряжается отрицательно. На катоде - участке поверхности с более положительным потенциалом (цементит) происходит восстановление ионов и молекул раствора, например:
2H++2e- = H2
O2+4H++4e- = 2H2O
O2+2H2O+4e- = 4OH-
Катод при этом заряжается положительно. Катодами могут быть не только зерна цементита, но и включения металлов с более положительным потенциалом или различных неметаллов. Наличие электронной проводимости у металла и ионной у раствора электролита позволяет анодным и катодным процессам протекать на различных участках поверхности металла. Между анодом и катодом протекает электрический ток - образуется замкнутый гальванический элемент.
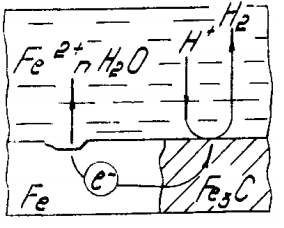
Рисунок 2 - схема электрохимической коррозии стали в кислоте
 |
На нашем сайте Вы можете заказать решениe заданий по всем разделам материаловедения. |