Материаловедение
Кристаллизация металлов
Любое вещество может находиться в одном из четырех агрегатных состояний: твердом, жидком, газообразном и плазменном. Агрегатное состояние определяется энергией взаимодействия атомов. Стабильным (равновесным) при определенных внешних условиях является состояние вещества, при котором оно обладает минимумом свободной энергии. Свободная энергия — часть внутренней энергии вещества. Внутренняя энергия вещества — это сумма потенциальной энергии (энергии взаимодействия) и кинетической энергии частиц (тепловые колебания). Часть внутренней энергии, высвобождающаяся при переходе вещества из одного состояния в другое,называется свободной энергией. Чем больше высвободится свободной энергии, тем меньшей энергией будет обладать вещество, тем более стабильно его состояние. Свободную энергию можно представить как аналог потенциальной энергии (рис. 1).
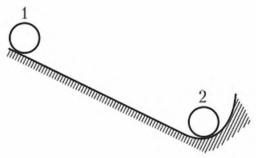
Рисунок 1 - Стремление системы к уменьшению свободной энергии
В положении 1 шарик имеет максимальную потенциальную энергию. Это положение не является устойчивым, шарик скатывается в положение 2, при котором его потенциальная энергия будет равна 0. Вещество может находиться в метастабильном состоянии (закаленная сталь). Такое состояние не обладает минимумом свободной энергии, но является достаточно устойчивым (стабильным). Вещество в метастабильном состоянии может находиться бесконечно долго при условии постоянства внешних факторов.
Первичная кристаллизация металлов и сплавов. Кристаллизация — это переход металла из жидкого состояния в твердое с образованием кристаллического строения. Это первичная кристаллизация (в отличие от вторичной, когда кристаллы металлических фаз выделяются из твердого вещества).
Рассмотрение кристаллизации для металлов и сплавов на их основе связано с тем, что эти материалы получают методом литья, тогда как многие неметаллические материалы производят другими способами. Ряд неметаллических материалов существует в природном виде (углерод), многие химические соединения получают путем химических реакций: карбиды — карбидизацией, нитриды — азотированием и т.п. Процесс кристаллизации (затвердевания) обусловлен стремлением системы к переходу в более устойчивое термодинамическое состояние. При изменении внешних условий, например температуры, свободная энергия системы меняется различно для жидкого и твердого (кристаллического) состояния (рис. 2). Выше температуры Ts более стабильным
является жидкое состояние, так как металл в этом состоянии имеет меньший запас свободной энергии. Ниже температуры Ts меньшим запасом свободной энергии обладает металл в твердом состоянии. При температуре величины свободных энергий твердого и жидкого состояний равны. Это означает, что металл может находиться в обоих состояниях бесконечно долго, так как переход из одного состояния в другое не будет сопровождаться уменьшением свободной энергии. Температура Ts получила название теоретической температуры кристаллизации.
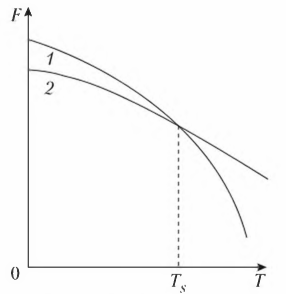
Рисунок 2 - Изменение свободной энергии (Ts) в зависимости от температуры (Т) жидкого (1) и твердого (2) состояния вещества
Для начала кристаллизации необходимо, чтобы свободная энергия металла в твердом состоянии стала меньше свободной энергии жидкого состояния. Это становится возможным при охлаждении жидкости ниже Ts. Температура, при которой фактически начинается процесс кристаллизации, называется фактической температурой кристаллизации (Тк). Охлаждение жидкого металла ниже теоретической температуры кристаллизации называется переохлаждение, а разность между теоретической и фактической температурой кристаллизации — степенью переохлаждения (ΔТ):
ΔТ=Тs - Тk
Степень переохлаждения зависит от скорости охлаждения жидкого металла. С увеличением скорости охлаждения понижается фактическая температура кристаллизации и, следовательно, возрастает степень переохлаждения. Процесс кристаллизации можно описать с помощью кривых охлаждения, построенных в координатах «температура — время» (рис. 3). Охлаждение в жидком состоянии сопровождается плавным понижением температуры (участок 1 кривой охлаждения), при достижении температуры кристаллизации на кривой охлаждения появляется горизонтальная площадка (участок 2 кривой охлаждения), т.е. охлаждение (понижение температуры) останавливается. Это вызвано тем, что отвод тепла компенсируется выделяющейся в процессе кристаллизации скрытой
теплотой кристаллизации. После полного перехода металла из жидкого состояния в твердое температура вновь начинает плавно снижаться (участок 3 кривой охлаждения). Увеличение скорости охлаждения от V1 до V3 приводит к увеличению степени
переохлаждения (см. рис. 3).
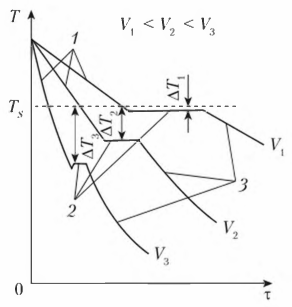
Рисунок 3 - Кривые охлаждения металла
Кристаллизация начинается с образования в жидком металле центров кристаллизации и продолжается за счет роста их числа и размеров (рис. 4). Процесс кристаллизации можно охарактеризовать двумя параметрами: числом центров кристаллизации (ЧЦК),

Рисунок 4- Схема процесса кристаллизации
образующихся в единицу времени в единице объема (1 см3/с), и скоростью роста кристаллов (СК ) [мм /с]. Эти параметры зависят от степени переохлаждения, а следовательно, от скорости охлаждения при кристаллизации металла. В соответствии с законом Таммана для каждой степени переохлаждения указанные параметры могут иметь только одно значение (рис. 5).
При теоретической температуре кристаллизации ( Ts) значения ЧЦК и СК равны 0 и кристаллизация происходить не может. При повышении степени переохлаждения значения ЧЦК и СК возрастают, процесс кристаллизации идет быстро. Это объясняется тем, что при высоких температурах, близких к Тs подвижность атомов велика. При определенных степенях переохлаждения значения ЧЦК и СК достигают максимума, после чего снижаются вследствие уменьшения подвижности атомов при низких температурах.
Размер образовавшихся в процессе кристаллизации зерен зависит от соотношения величин ЧЦК и СК, т.е. определяется степенью переохлаждения (скоростью охлаждения
металла в процессе кристаллизации). При малых степенях переохлаждения (низкой скорости охлаждения металла) образуется малое число центров кристаллизации, которые
растут с большой скоростью,---- АТ' (см. рис. 5). В этом случае структура металла после окончания кристаллизации будет крупнозернистой. При больших степенях переохлаждения, напротив, ЧЦК велико, а СК мала (ДГ" - АТ”'), поэтому структура металла получается мелкозернистой.
Если степень переохлаждения настолько велика, что значения ЧЦК и СК близки к пулю, кристаллизации не происходит. При этом образуется твердое тело, имеющее не кристаллическое строение с «правильным» расположением атомов, а аморфное — с хаотическим расположением атомов — «твердая жидкость». Аморфное состояние
характерно для неметаллических материалов (стекла, полимеры). Для получения аморфного состояния у металлических материалов требуется очень большая скорость охлаждения 106... 107 °С/с.